字少事大-国采倒计时

本文转自公众号:医休神介说、医休器械
2024年11月1日,国家组织高值医用耗材联合采购办公室发布国家组织人工耳蜗类及外周血管支架类医用耗材集中带量采购公告(第1号)(以下简称:1号公告)。

1号公告明确了此次集采的品种、产品分组、企业资质、医疗机构范围等信息,并明确将延续前序批次集采成熟做法,根据医疗机构报量等情况划分A、B竞价单元。
划分的规则是,供应能力较强、医疗机构累计报量前85%的企业进入A竞价单元,其他企业进入B竞价单元。这一规则通过1号公告在报量前发布,是维护集采公平公正以及逻辑链条的必备步骤。1号公告发布后,联合采购办公室将组织医疗机构结合临床历史使用状况、医疗技术进步等因素,从有意愿供应本辖区的企业中选择产品,填报采购需求量,并汇总采购需求量后按一定比例形成意向采购量。
同时,1号公告要求申报企业维护本次集采范围内的产品信息、企业间关联关系,并填报供应区域及供应中国市场的年最大产能信息,为后续集采规则的制订提供信息基础。
报量结束后,联合采购办公室将根据医疗机构报量、企业产品信息维护情况形成2号公告,进一步明确中选规则、带量规则等,公布现场开标的时间、场地等关键信息。欢迎社会各界持续关注本次集采后续动态,支持高值医用耗材集采工作。
国家组织高值医用耗材联合采购办公室
2024年11月1日
医休点评:
昨天是甘肃牵头的20省市外周耗材采购联盟,前面还有安徽的拟带量采购通知发出,感觉到了年底,有关部门要顶着压力完成年度KPI了,争取在年终评优评先获得一个不错的分数。
随着多个省份和多类产品进入集采,考验企业市场准入和渠道能力的时候到了,每一次集采也是企业拉开身位的好时机。

不过显然很多企业没有准备,我们搭建了器械商务渠道交流群,主要交流医疗器械相关的准入政策、医保以及集采相关信息和经验,入群可及时迅速地了解各种政策信息。
注:本群为付费社群,企业政策商务相关人员可免费进。
附:国家组织人工耳蜗类及外周血管支架类医用耗材集中带量采购公告(第1号)
为深入推进高值医用耗材集中带量采购改革,根据国务院办公厅《关于印发治理高值医用耗材改革方案的通知》(国办发〔2019〕37号)、国家医保局等八部门《关于开展国家组织高值医用耗材集中带量采购和使用的指导意见》(医保发〔2021〕31号)要求,按照国家组织、联盟采购、平台操作的总体思路,全国各省份组成采购联盟,委派代表组成国家组织高值医用耗材联合采购办公室(以下简称“联合采购办公室”),代表各地区公立医疗机构(含军队医疗机构,下同)及积极参加的医保定点社会办医疗机构等开展国家组织人工耳蜗类及外周血管支架类医用耗材集中带量采购。由天津市医药采购中心承担联合采购办公室日常工作并负责具体实施。现就有关事项公告如下:
一、采购产品
本次集中带量采购产品为人工耳蜗类及外周血管支架类医用耗材。
(一)产品范围
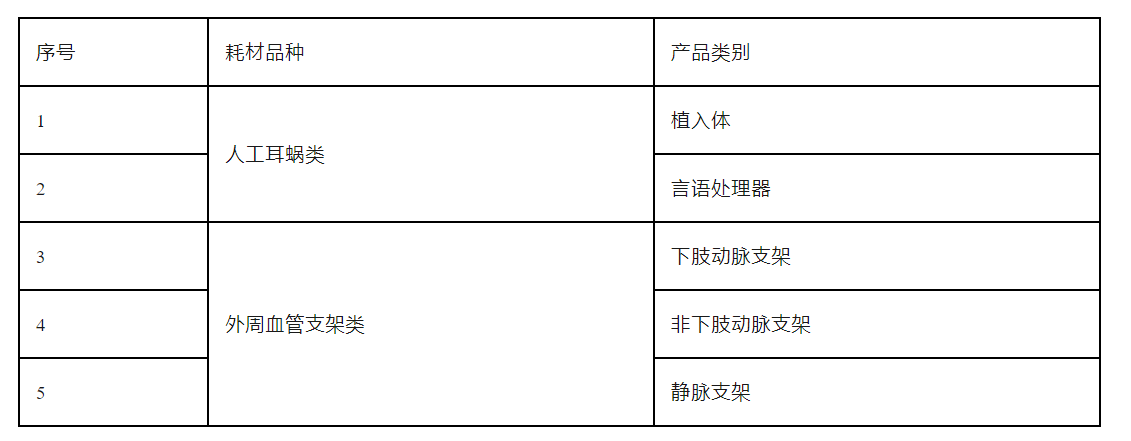
1.人工耳蜗类相关耗材:获得中华人民共和国医疗器械注册证的人工耳蜗类医用耗材,包含植入体、言语处理器等。
2.外周血管支架类相关耗材:获得中华人民共和国医疗器械注册证的外周血管支架类(不含胸主动脉支架、腹主动脉支架)医用耗材。
(二)产品类别
各产品类别见下表。
(三)材质要求
外周血管支架耗材材质包括:镍钛合金、铂铱合金、钴铬合金、镍钴基合金、镍钛诺合金、不锈钢等。
二、企业资质
申报企业为已取得本次集中带量采购产品合法资质的医疗器械注册人(含备案人,下同),在产品质量标准、生产能力、供应能力、企业信用等方面满足以下要求的,均可参加。其中,境外医疗器械注册人应当指定我国境内企业法人协助其履行相应的法律义务,并作为申报企业开展申报,同一境外医疗器械注册人应当委托同一家企业申报。符合采购产品和企业资质要求的企业须于规定时间内在国家医保服务平台-国家组织高值医用耗材集中采购信息填报系统维护产品信息。(一)申报产品应当符合国家有关部门的质量标准要求,并按国家有关部门要求组织生产。(二)申报企业须明确供应区域,并承诺申报的各产品对应所有规格型号在采购周期内满足该区域采购需求。(三)申报企业和医疗器械注册人应遵守《中华人民共和国专利法》《中华人民共和国反不正当竞争法》《中华民共和国反垄断法》等相关法律法规,并承担相应法律责任。(四)申报企业和医疗器械注册人未被列入当前《全国医药价格和招采失信企业风险警示名单》,未被联合采购办公室列入当前“违规名单”。(五)同一医疗器械注册人的产品不得委托不同企业申报。(六)不同医疗器械注册人或申报企业为同一实际控制人或存在控股关系的,各医疗器械注册人和申报企业之间均视为存在关联关系。同一企业代表不同医疗器械注册人申报的,相关企业视为存在关联关系。(七)医疗器械注册人为同一实际控制人或存在控股关系的,如委托同一家企业申报,视为同一申报企业,同一产品类别,应提交一份唯一报价的申报材料;境外企业国内设厂生产的,其境外医疗器械注册人指定的申报企业与国内医疗器械注册人,视为同一申报企业,应提交一份唯一报价的申报材料;医疗器械注册人非同一实际控制人,且不存在控股关系的,如委托同一家企业申报,视为不同申报企业,应分别提交申报材料。
三、医疗机构范围
有使用人工耳蜗类及外周血管支架类相关耗材的公立医疗机构(含军队医疗机构,下同)均应参加。引导和鼓励医保定点社会办医疗机构在承诺遵守本次集采规定的前提下,按所在省(区、市)的相关规定积极参加。
四、采购规则
(一)意向采购量
联合采购办公室组织企业维护产品信息,组织医疗机构填报采购需求量,并汇总采购需求量后按一定比例形成意向采购量。1.企业维护产品信息。申报企业按照本公告“一、采购产品”中的要求,维护属于本次集采范围的全部医疗器械注册证产品信息,确保满足临床使用需求,确认供应区域范围,并填报供应中国市场的年最大产能信息。2.医疗机构填报采购需求量。医疗机构结合临床历史使用状况、医疗技术进步等因素,从有意愿供应本辖区的企业中选择产品,并如实准确填报每个产品未来一年的需求量(外周血管支架类产品须具体到每个产品的适用部位)。3.联合采购办公室汇总医疗机构填报的采购需求量,按一定比例明确本次集中带量采购的意向采购量。
(二)竞价单元
人工耳蜗类相关耗材:不区分竞价单元,将每个产品类别作为一个竞价单元竞价比价。外周血管支架类相关耗材:为确保临床使用和供应稳定,兼顾各类型产品和企业的原则,综合考虑医疗机构需求、企业供应意愿和供应能力等因素,将企业分单元分别竞价。同一产品类别下,同时满足如下条件的申报企业进入A竞价单元,其他进入B竞价单元:1.根据医疗机构需求量由多到少依次排序,取该产品类别累计需求量前85%(含)且能供应全国所有地区的企业;2.如进入A竞价单元企业数量不足5家,在能供应全国所有地区且需求量大于0的有效申报企业中,根据医疗机构需求量由多到少将A竞价单元依序递补至5家。如能供应全国所有地区且需求量大于0的有效申报企业不足5家,则全部进入A竞价单元。当拟递补的企业需求量为0时不予递补。(三)竞价规则企业以产品类别申报价格,每一个产品类别的所有产品仅允许有一个申报价。灭菌与非灭菌不作区分。1.人工耳蜗类医用耗材申报价格包含产品价格(含配送费用、配套工具配送费用、配套工具使用费用及伴随服务费用);其中植入体的申报价格为植入体部件价格,言语处理器的申报价格须包含言语处理器部件价格、1次调机费用、1次售后服务费用(包括但不限于配件维修、软件升级等)。人工耳蜗产品需标明每个部件、1次调机费用、1次售后服务费用的单价,其中植入体、言语处理器分别不得高于其最高有效申报价申报。单列其他可单独更换的配件(1根言语处理器导线(一体式除外)、1个言语处理器线圈等)的价格。按照质量、功能与价格相匹配的原则,同一类别中的部分产品形成竞价比价关系。在植入体类别中,支持3.0T核磁与不支持3.0T核磁的植入体按一定比例比价(具体比价关系另行公告)。2.外周血管支架类医用耗材申报价格包含产品价格、配送和配套使用工具及伴随服务费用。按照质量、功能与价格相匹配的原则,同一类别中的部分产品形成竞价比价关系。如,覆膜支架与非覆膜支架按一定比例比价;药物涂层支架与非药物涂层支架按一定比例比价;不同长度支架按一定比例比价等(具体比价关系另行公告)。
(四)拟中选规则
人工耳蜗类医用耗材企业以植入体的申报价格与言语处理器的申报价格之和开展竞价,外周血管支架类医用耗材各竞价单元内企业以产品类别开展竞价,通过价格竞争产生拟中选企业。A、B竞价单元内,竞价比价价格不高于最高有效申报价视为有效报价;按有效申报企业竞价比价价格由低到高排序,在满足价差控制在合理范围等条件下,产生拟中选企业(具体规则另行公告)。
(五)分量规则
坚持临床需求导向,尊重医疗机构自主选择,按照量价挂钩原则,实行梯度带量,引导竞争。第一步,分基础量。中选企业按照竞价比价价格由低到高排名,根据排名先后梯度分配基础量,排名靠前的中选企业带量比例较高,排名靠后的中选企业带量比例较低。第二步,分剩余量。中选产品未分配的意向采购量及非中选产品的意向采购量共同组成剩余量,由医疗机构按一定规则自主选择,将剩余量分配给中选企业,对中选顺位靠前的企业予以倾斜,对中选顺位靠后的企业适当约束。外周血管支架类相关耗材:剩余量在同一产品类别下,按适用部位跨A、B竞价单元分配。剩余量分配时,适当考虑用量较少医疗机构的特殊性。
(六)采购周期
本次人工耳蜗类及外周血管支架类医用耗材集中带量采购周期3年,以联盟各地区中选结果实际执行日起计算。采购周期内医疗机构每年应完成当年协议采购量,超出协议采购量的部分,中选企业仍需按中选价格供应,直至采购周期届满。
(七)产品新增
采购周期内,如中选企业未申报或新获批的产品接受该企业同产品类别中选价,由企业向联合采购办公室申请,可作为中选产品挂网;如未中选企业或新获批企业的产品接受不高于同产品类别最高中选价,由企业向联合采购办公室申请后挂网,不作为非中选产品统计;如中选产品注册证更新,中选资格及中选价格维持不变。境外企业中标后如在国内设厂生产,并获得同产品类别产品批件,视同中选企业新获批产品。
(八)其他要求
1.采购周期内,医疗机构优先使用中选产品,并确保完成协议采购量。2.各省(区、市)进一步加强对非中选产品的挂网管理,要按照性能和价格相匹配的原则,考虑与中选产品的合理比价关系,将非中选产品挂网价格进一步导入合理区间,并加强执行过程中的监测监管。3.人工耳蜗类相关耗材产品保修期内,企业需按保修条款处理。植入体保修期不少于10年;言语处理器保修期不少于3年;言语处理器导线保修期不少于2年;线圈保修期不少于3年。保修期外,企业需按照其申报的单价提供相关配件以及售后服务。4.为进一步保障人工耳蜗类相关耗材产品长期及稳定的售后服务,拟建立人工耳蜗数据登记系统,由医院或企业录入患者使用信息,包括调机、配件更换、售后维修等服务及价格信息,患者可登录系统进行实时监测,如信息不符,可通过系统投诉反馈。确保使用数据真实可追溯,规范企业售后服务行为。5.申报企业作为供应保障的第一责任人,中选后及时、足量按要求组织生产,落实耗材追溯法定责任,按规定提供追溯信息,确保耗材的流向清晰可查、质量可追溯。6.鼓励各省依托招采子系统开展人工耳蜗类和外周血管支架类医用耗材采购,并与耗材经营企业、生产企业开展直接结算。
五、申报企业信息维护
申报企业使用数字证书登录国家医保服务平台-国家组织高值医用耗材集中采购信息填报系统(fuwu.nhsa.gov.cn),进入人工耳蜗类及外周血管支架类医用耗材集采系统,在“企业间关系”菜单,填报企业间关联关系(含同一实际控制人、存在控股关系、多家企业委托一家企业申报等);在“产能填报”菜单,填报供应中国市场的年最大产能信息。具体操作方法详见系统内操作手册。时间安排:2024年11月4日至11月8日。
六、联系方式
联系地址:天津陈塘科技商务区服务中心四楼(天津市河西区洞庭路20号)联系电话:022-24538155服务时间:9:00-12:00,14:00-16:30,节假日除外。其他未尽事宜另行公告。国家组织高值医用耗材联合采购办公室2024年11月1日
本文2024-11-03 15:24:37发表“医休观点”栏目。
本文链接:https://www.yixiuqixie.com/article/536.html
阅读排行
- 手慢无!10款已上市密网支架·最全参数对比
- 新源脑科学完成数千万元Pre-A轮融资,加速脑功能监测与神经调控产品落地
- 合珀生物完成数百万元天使轮融资,加速3D器官模型研发,助力革新药物研发进程
- 国家药监局关于暂停进口、经营和使用韩国杰希思医疗公司Nd:YAG激光治疗仪的公告
- 加速注射笔产能布局,英捷信医疗顺利完成数千万元A轮融资
- 健适医疗完成2500万美元战略融资,进一步增强企业产品研发能力和发展运营模式
- 靠大单品融资超13亿元,这家关节植入物制造商16年只做一个产品
- IVD新品:万孚、万泰、达安基因、东方生物、雅培等
- 广州某院长“被下架”(还未过试用期)
- 基于运动想象范式,搭建独特算法,韶脑科技有望将脑卒中康复周期缩短1/3