国家局抽检,17个品种有24批(台)产品不合格,涉及高频电刀、取石网篮、抽吸导管等...

来源:医休研究院、医休器械(www.yixiuqixie.com)
国家药监局关于发布国家医疗器械监督抽检结果的通告(2024年第35号)
为加强医疗器械监督管理,保障医疗器械产品质量安全有效,国家药品监督管理局组织对半导体激光治疗机、疤痕修复凝胶等17个品种进行了产品质量监督抽检,有24批(台)产品不符合标准规定。具体情况通告如下:
一、被抽检项目不符合标准规定的医疗器械产品
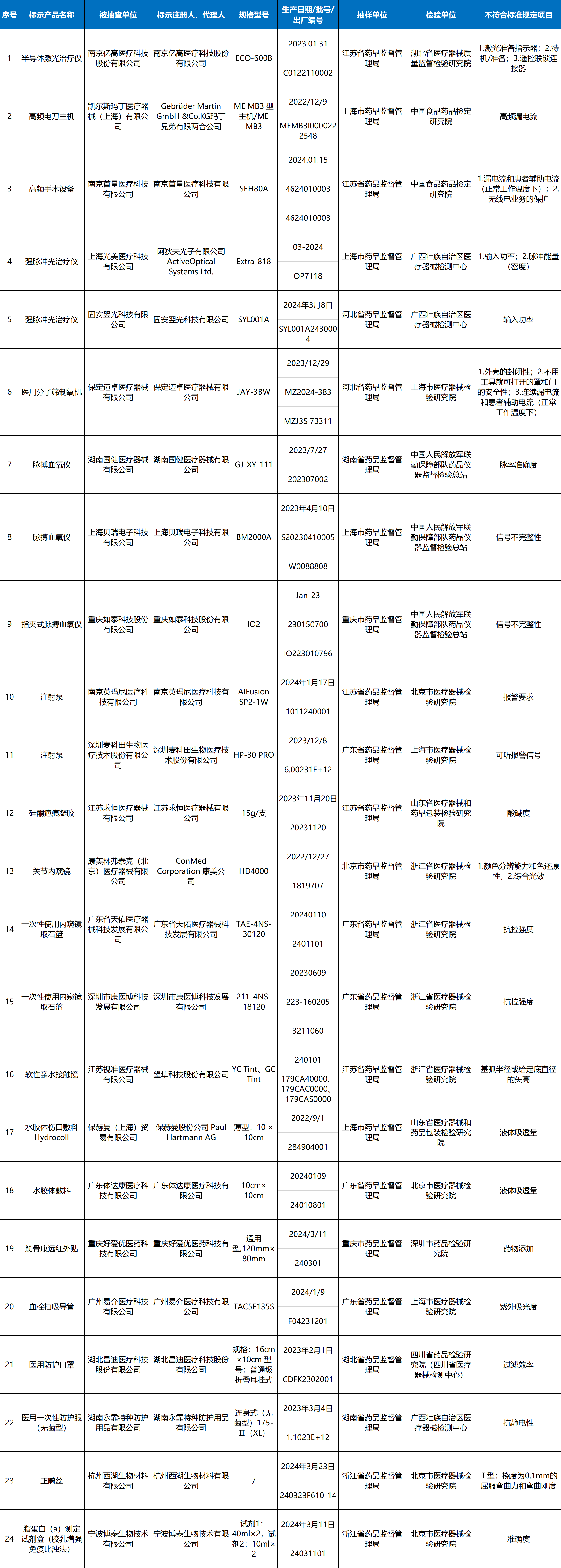
1-半导体激光治疗机1台:
南京亿高医疗科技股份有限公司生产,涉及激光准备指示器、待机/准备、遥控联锁连接器不符合标准规定。
2-高频电刀2台:
分别为Gebrüder Martin GmbH&Co.KG玛丁兄弟有限两合公司、南京首量医疗科技有限公司生产,涉及高频漏电流、漏电流和患者辅助电流(正常工作温度下)、无线电业务的保护不符合标准规定。
3-强脉冲光治疗仪2台:
分别为阿狄夫光子有限公司ActiveOptical Systems Ltd.、固安翌光科技有限公司生产,涉及输入功率、脉冲能量(密度)不符合标准规定。
4-医用分子筛制氧机1台:
保定迈卓医疗器械有限公司生产,涉及外壳的封闭性、不用工具就可打开的罩和门的安全性、连续漏电流和患者辅助电流(正常工作温度下)不符合标准规定。
5-医用脉搏血氧仪3台:
分别为湖南国健医疗器械有限公司、上海贝瑞电子科技有限公司、重庆如泰科技股份有限公司生产,涉及脉率准确度、信号不完整性不符合标准规定。
6-注射泵2台:
分别为南京英玛尼医疗科技有限公司、深圳麦科田生物医疗技术股份有限公司生产,涉及报警要求、可听报警信号不符合标准规定。
7-疤痕修复凝胶1批:
江苏求恒医疗器械有限公司生产,涉及酸碱度不符合标准规定。
8-关节内窥镜1批:
ConMed Corporation康美公司生产,涉及颜色分辨能力和色还原性、综合光效不符合标准规定。
9-取石网篮2批:
分别为广东省天佑医疗器械科技发展有限公司、深圳市康医博科技发展有限公司生产,涉及抗拉强度不符合标准规定。
10-软性接触镜1批:
望隼科技股份有限公司生产,涉及基弧半径或给定底直径的矢高不符合标准规定。
11-水胶体敷料2批:
分别为保赫曼股份公司Paul Hartmann AG、广东体达康医疗科技有限公司生产,涉及液体吸透量不符合标准规定。
12-贴敷类医疗器械(远红外治疗贴、磁疗贴、穴位磁疗贴、退热贴)1批:
重庆好爱优医药科技有限公司生产,涉及检出“按照补充检验方法要求不得检出的相关药物成分”。
13-血栓抽吸导管1批:
广州易介医疗科技有限公司生产,涉及紫外吸光度不符合标准规定。
14-医用防护口罩1批:
湖北昌迪医疗科技股份有限公司生产,涉及过滤效率不符合标准规定。
15-医用一次性防护服1批:
湖南永霏特种防护用品有限公司生产,涉及抗静电性不符合标准规定。
16正畸丝1批:
杭州西湖生物材料有限公司生产,涉及Ⅰ型:挠度为0.1mm的屈服弯曲力和弯曲刚度不符合标准规定。
17脂蛋白(a)测定试剂盒1批:
宁波博泰生物技术有限公司生产,涉及准确度不符合标准规定。
以上抽检不符合标准规定产品具体情况见附件。
二、监管要求
对抽检发现的不符合标准规定产品,国家药品监督管理局已要求企业所在地省级药品监督管理部门按照《医疗器械监督管理条例》《医疗器械生产监督管理办法》《医疗器械召回管理办法》等要求,及时作出行政处理决定并向社会公布。省级药品监督管理部门要督促企业对抽检不符合标准规定产品进行风险评估,根据医疗器械缺陷的严重程度确定召回级别,主动召回产品并公开召回信息;督促企业尽快查明产品不合格原因,制定整改措施并按期整改到位。
特此通告。
本文2024-09-14 12:59:50发表“医休观点”栏目。
本文链接:https://www.yixiuqixie.com/article/403.html
阅读排行
- 手慢无!10款已上市密网支架·最全参数对比
- 新源脑科学完成数千万元Pre-A轮融资,加速脑功能监测与神经调控产品落地
- 合珀生物完成数百万元天使轮融资,加速3D器官模型研发,助力革新药物研发进程
- 国家药监局关于暂停进口、经营和使用韩国杰希思医疗公司Nd:YAG激光治疗仪的公告
- 加速注射笔产能布局,英捷信医疗顺利完成数千万元A轮融资
- 健适医疗完成2500万美元战略融资,进一步增强企业产品研发能力和发展运营模式
- 靠大单品融资超13亿元,这家关节植入物制造商16年只做一个产品
- IVD新品:万孚、万泰、达安基因、东方生物、雅培等
- 广州某院长“被下架”(还未过试用期)
- 基于运动想象范式,搭建独特算法,韶脑科技有望将脑卒中康复周期缩短1/3