合珀生物完成数百万元天使轮融资,加速3D器官模型研发,助力革新药物研发进程
3D器官模型技术研发商——上海合珀生物科技有限公司(下称“合珀生物”)宣布完成数百万元天使轮融资。本轮融资由张江生命健康产业孵化天使基金(张科禾苗基金)领投,青岛臻泽医疗产业投资基金等跟投,融资资金将用于合珀生物3D器官模型产品的产业化应用与市场推广,助力革新药物研发进程。
合珀生物成立于2022年12月,致力于3D器官模型及器官芯片技术的创新研发,旨在为药物非临床研究提供更可靠的安全性、有效性评价。
目前,合珀生物已开发出多个成熟产品,包括肝脏、肠、血脑屏障、神经、肿瘤等诸多3D体外模型,并成功应用于药物非临床研究,目前已与默克、礼来、吉利德、恒瑞达成合作。
2022年被视为类器官和器官芯片行业“里程碑”的一年。这一年,FDA现代化法案2.0通过,取消了药物开发过程中对动物试验的强制性,推动包括3D器官模型在内的多样化临床前测试模型的使用;首个完全基于器官芯片研究获得临床前疗效数据的新药获批进入临床试验。
在这一年,类器官与器官芯片行业迎来了突飞猛进的发展。其中,国内多个企业走出学术研究范畴,参与到市场竞争中。
合珀生物便是其中一员。2022年12月,合珀生物由瑞典卡罗琳斯卡医学院、中国药科大学教授及校友联合创立。其中,公司联合创始人周婷婷是瑞典卡罗琳斯卡医学院医学信息学硕士,在生物医药领域拥有十余年孵化和投资经验。
合珀生物的另一位联合创始人、CSO——Volker Lauschke教授是卡罗林斯卡医学院教授、Dr. Margarete Fischer-Bosch临床药理研究所副所长、国际基础和临床药理联合组织(IUPHAR)成员。
在学术研究方面,Volker Lauschke教授在国际同行评审杂志发表了100余篇论文,论文引用次数超过1000次。基于已有研究成果,他曾荣获遗传学、药理学和药物发现领域的多个奖项,例如Malin and Lennart Philipson Prize、AAPS美国药学科学家协会 High Impact Award等。
在核心团队的推动下,合珀生物经过2年的持续研发与战略布局,已成功实现核心技术的创新转化,并且正在稳步推进产品的商业化进程。
凭借Volker Lauschke教授以及研发团队的数十年的研究积累与技术优势,合珀生物在不到2年的时间里便打造了一个行业领先的3D器官模型平台。
依托于自主建立的人原代细胞库及独创的3D器官模型培养技术,合珀生物打造了核心3D器官培养系统。值得注意的是,合珀生物采用纯化学定义的培养基配方,其不含基质胶、生长因子等成分。这意味着,通过该培养基配方研发的3D器官模型无批次间差异性,且模型实验可重复性强。当前的3D细胞培养仍然极大地依赖动物来源的血清和支架材料,而这些物质既造成了与人类生理环境有差别的培养条件,也会对药物的测试造成批次间差异。合珀生物采用化学定义的培养条件,促进药物测试的稳定和可重复。
此外,通过采用球体共培养技术,合珀生物可将3D器官模型与免疫细胞、胆管细胞、肝星状细胞、内皮细胞共培养,并复现其功能。
依托这一核心技术平台,合珀生物研发出了 拳头产品之一——3D肝脏器官模型。据悉,该模型构建时间仅需5天,构建成功率高达100%,且该模型通过转录组、蛋白组、代谢组等全面的组学数据论证了其与人肝表型的高度一致性,并且通过了学术界和产业界的大规模、多中心实验验证其稳定性和可重复性。根据合珀生物公布的实验数据,该模型能够稳定维持肝脏表型与功能长达35天以上。在较低的暴露浓度下,肝毒性测试的特异性为100%,并且能实现高通量筛选。
此外,围绕3D肝脏器官模型,合珀生物还搭建了肝毒性评价平台、体外ADME平台、肝脏疾病(MASH、肝纤维化)高通量药效筛选平台,能够为药物的研发和安全性评估提供多种创新工具和方法。
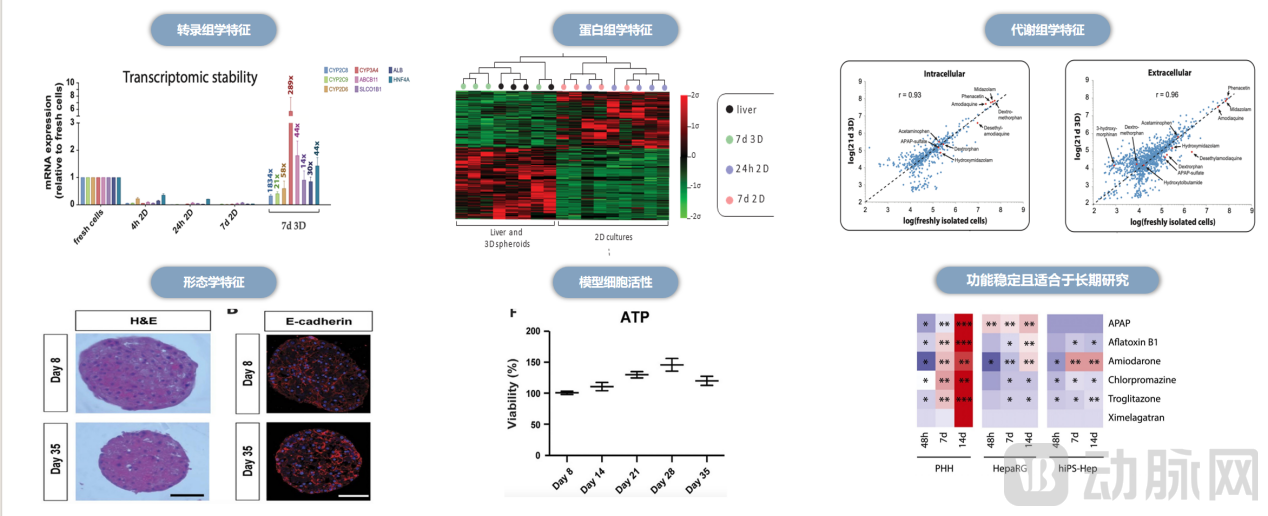
3D肝脏器官模型组学数据 图源:合珀生物
目前,合珀生物开发出了诸多3D器官模型产品,除了肝脏以外,还包括肠、血脑屏障、肿瘤类器官、皮肤、肾脏,从多个产品条线多元化布局药物非临床研究。
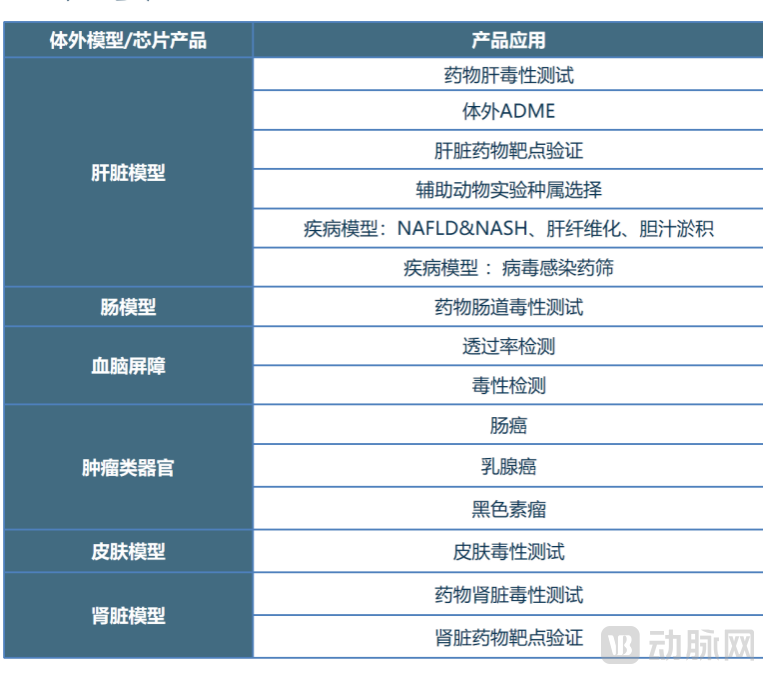
合珀生物产品类别 图源:合珀生物
高通量的体外生理模型为药物开发提供了相对可靠的平台,使药物筛选、药效和安全性评估、疾病研究等环节的效率和准确性不断提高,并极大节约了研发成本和时间。
然而,包括类器官、微流控芯片、3D生物打印等在内的体外组织工程技术仍存在一定的局限性。例如,目前大部分3D器官模型技术无法准确模拟其应当代表的人体组织的功能和反应。同时,当前多数体外模型缺乏适当的表征和基准测试,不能完整反映组织器官的状态,导致结果缺乏可靠性;此外,当前的大多数3D细胞培养不能摆脱动物源性物质对试验的干扰,既造成了与人类生理环境有差别的培养条件,也会对药物的测试造成批次间差异。
而面对这些难题,合珀生物通过十几年的研发已逐步克服这些问题。合珀生物联合创始人、CSO Volker Lauschke教授表示:“The technology that Hepo uses has overcome these issues by investing a decade of research and development in the technology. This includes academic and as well as pharmaceutical development and careful standardization and benchmarking to other technologies not only by us, but in unbiased multi-centre trials that involved both industrial and university partners. It was the unambiguous finding that our technology outperforms other culture systems.”
据其介绍,合珀生物的3D肝脏模型已与默克、礼来、吉利德、恒瑞等多家著名药企达成合作。例如,其3D肝脏球体模型曾被用于礼来巴瑞替尼新适应症开发过程中。研究数据显示,通过用SARS-CoV-2病毒感染3D肝脏球体模型后,其产生的炎症反应能够模拟宿主细胞对病毒的炎症反应。基于此,巴瑞替尼被证明可以抑制IFN造成的炎症反应。最终,该数据在3期临床试验中得到验证,并被FDA接受,巴瑞替尼获得了FDA紧急使用授权。
目前合珀生物在已有商业化产品的基础上,不断拓展产品开发边界,推动皮肤、肿瘤等类器官模型的开发构建。
未来,合珀生物将始终围绕药物研发需求,一方面不断拓展3D器官管线,针对物种间差异比较大的器官,人源性3D体外模型可以提供更接近人体内的安全性、有效性评价;另一方面也将布局AI驱动的从体外数据到体内效果的预测平台。
此外,合珀也将结合肝脏3D模型技术,布局中药肝毒性研究。中药作为中国传统医药,不仅在中国有着悠久的历史和广泛的使用,而且在全球范围内也逐渐受到重视和认可。但中药因其复杂成分和作用机制,在安全性评价中需要特别关注肝毒性问题。合珀3D肝脏模型能够为中药肝毒性研究提供可靠的体外模型,让中药得以更安全的使用。
当下,3D器官模型结合动物试验评估、验证药物安全性和有效性的流程和方法目前已越来越成为主流。然而,尽管动物实验因其整体性优势在某些方面仍不可替代,但对于一些物种间差异较大、容易引发不良反应的器官,如肝脏和肠道等,则会导致试验结果的不确定性增加。因此,在药物研发早期阶段,结合使用3D器官模型进行非临床评价,能够帮助避免在临床二期或三期时才发现药物性肝损伤或药物相互作用所带来的重大损失,进而提升整个研发流程的效率。
对此,合珀生物联合创始人周婷婷也表示:“物种间差异一直是动物模型在药物研发中面临的重大挑战,导致了研发过程中的巨大损失。我们相信,未来3D器官模型与动物实验相结合的方式将成为药物研发的标准流程。合珀生物致力于通过3D器官模型,在药物研发的早期阶段提供更接近人体的安全性和有效性评价。未来,合珀生物将继续推动这项技术的发展,帮助更多制药企业和科研机构加速药物开发,最终惠及广大患者。”
本文2024-08-26 13:48:04发表“行业新闻”栏目。
本文链接:https://www.yixiuqixie.com/article/304.html
阅读排行
- 手慢无!10款已上市密网支架·最全参数对比
- 新源脑科学完成数千万元Pre-A轮融资,加速脑功能监测与神经调控产品落地
- 合珀生物完成数百万元天使轮融资,加速3D器官模型研发,助力革新药物研发进程
- 国家药监局关于暂停进口、经营和使用韩国杰希思医疗公司Nd:YAG激光治疗仪的公告
- 加速注射笔产能布局,英捷信医疗顺利完成数千万元A轮融资
- 健适医疗完成2500万美元战略融资,进一步增强企业产品研发能力和发展运营模式
- 靠大单品融资超13亿元,这家关节植入物制造商16年只做一个产品
- IVD新品:万孚、万泰、达安基因、东方生物、雅培等
- 基于运动想象范式,搭建独特算法,韶脑科技有望将脑卒中康复周期缩短1/3
- 36家医疗器械CDMO平台盘点